ハイドロキシアパタイト (Ca
10 (PO
4)
6 (OH)
2) はリン酸カルシウム系化合物で人の骨や歯の主な無機成分です。生体親和性が高く、人工骨等のバイオマテリアルとして使用される材料です。
ハイドロキシアパタイトクロマトグラフィーの歴史
1956年にスウェーデンのウプサラ大学で最初にハイドロキシアパタイトを用いたクロマトグラフィーが開発されました。
1980年代までカラム充填剤としてのハイドロキシアパタイトは研究者が自分でリン酸とカルシウムから結晶を合成するものであり作成条件は定まっていませんでした。そのために合成された粒子の大きさ、形は不均一で不定形なために高流速で流すと粒子が壊れてカラムが詰まり、繰り返し使用に耐えられないものでした。
HOYA Technosurgical(株)のハイドロキシアパタイトクロマトグラフィーの歴史
1980年代後半弊社(当時 旭光学工業)がハイドロキシアパタイト結晶を球状セラミックス粒子化する技術を開発しクロマトグラフィーに応用させました。
球状セラミックス粒子化することにより、今までフレーク状だったハイドロキシアパタイト担体カラムの欠点である低耐久性、低流速、非再現性、ロット間差などが払拭されました。その後、2000年代以降にバイオ医薬品が隆盛を極める状況になり、この担体がバイオ医薬の精製工程で不純物を除去する効果が非常に高いことから、世界中の多くの製薬企業で採用されることになりました。

A:HOYA Technosurgical(株)の
セラミックス球状粒子
B:フレーク状ハイドロキシアパタイト粒子
HOYA Technosurgical(株)のハイドロキシアパタイトクロマトグラフィー製品の特徴
- 製品の安定性
- ロット間差の少なさ
- GMP グレードの工場で製造され高純度
- 供給安定性
HOYA Technosurgical(株)のハイドロキシアパタイト担体は、不純物除去性能の高さと分離性能の良さから世界中の製薬会社の抗体医薬やワクチンの製造で使用されています。
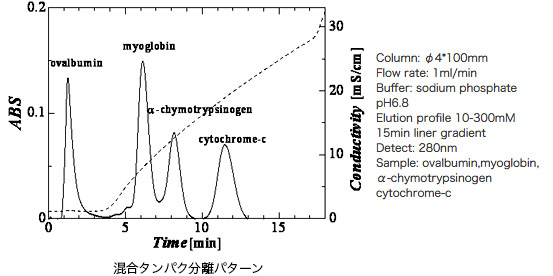
HOYA Technosurgical(株)のハイドロキシアパタイトクロマトグラフィー製品とタンパク分離パターン図
上図:ハイドロキシアパタイトクロマトグラフィー担体 CHT
下図:ハイドロキシアパタイトカラムによるリン酸緩衝液グラジエント溶出による4種類の混合タンパクの分離ピーク
左図:ハイドロキシアパタイトクロマトグラフィー担体 CHT
右図:ハイドロキシアパタイトカラムによるリン酸緩衝液グラジエント溶出による4種類の混合タンパクの分離ピーク
*CHTは HOYA Technosurgical(株)が製造、Bio-Rad Laboratories, Inc.が販売するクロマ トグラフィー担体製品です。
日本販売元 バイオ・ラッド ラボラトリーズ 株式会社 ライフサイエンス事業部
TEL: 03-6361-7000
http://discover.bio-rad.co.jp
HOYA Technosurgical(株)のハイドロキシアパタイトクロマトグラフィーの特許
| 特許番号 |
発明の名称 |
| JP4,172,937 |
粉体の製造方法 |
| JP5,198,815 |
粉末の製造方法 |
| JP5,248,904 |
被覆粒子、被覆粒子の製造方法および吸着装置 |
| JP5,301,804 |
フッ素アパタイトの乾燥粒子および吸着装置 |
| JP5,458,229 |
フッ素アパタイトの製造方法、フッ素アパタイトおよび吸着装置 |
| JP5,458,230 |
フッ素アパタイトの製造方法、フッ素アパタイトおよび吸着装置 |
| JP5,458,231 |
フッ素アパタイト粉体の製造方法、フッ素アパタイト粉体および吸着装置 |
| JP5,458,239 |
分離方法 |
| JP5,463,537 |
分離方法 |
| JP5,509,493 |
粉体の製造方法、粉体、吸着装置 |
| JP5,509,494 |
粉体の製造方法、粉体、吸着装置 |
| JP5,724,050 |
粉体、粉体の製造方法、吸着装置 |
| JP5,847,584 |
粉体、粉体の製造方法、吸着装置 |
| JP6,230,362 |
粉体の製造方法 |
| JP6,898,535 |
アパタイトカラムを使用したウィルスの精製方法 |
| JP6,892,563 |
帯電物質の精製方法 |
| JP6,951,051 |
吸着剤の生産方法 |
参考文献
ウィルス
- Kurosawa Y, Kurane I and Yamamoto A. Observation of Japanese encephalitis virus particles on ceramic hydroxyapatite by scanning electron microscopy. Med Biol. 153 (12), 607-610, 2009.
- Kurosawa Y, Saito M, Kobayashi S and Okuyama T. Purification of dengue virus particles by one-step ceramic hydroxyapatite chromatography. World Journal of Vaccines. 2, 155-160, 2012. DOI: 10.4236/wjv.2012.23020
- Kurosawa Y, Yamamoto A, Kurane I and Nakayama M. Development of a purification method for Japanese encephalitis virus particles using ceramic hydroxyapatite chromatography. Med Biol. 156, 410-416, 2012.
- M. Saito, Y. Kurosawa and T. Okuyama. Scanning electron microscopy-based approach to understand the mechanism underlying the adhesion of dengue viruses on ceramic hydroxyapatite columns. PLoS One 8(1), e53893, 2013. DOI: 10.1371/journal.pone.0053893
- Kurosawa Y, Saito M, Yoshikawa D and Snyder M. Mammalian virus purification using ceramic hydroxyapatite. Tech Note Bulletin 6549, Bio-Lad Laboratories, Inc. 2014.
http://www.bio-rad.com/webroot/web/pdf/lsr/literature/Bulletin_6549.pdf
- Minkner R, Baba R, Kurosawa Y, Suzuki S, Kato T, Kobayashi S and Park EY. Purification of human papillomavirus-like particles expressed in silkworm using a Bombyx mori nucleopolyhedrovirus bacmid expression system. J Chromatogr B. 1096, 39-47, 2018.
https://doi.org/10.1016/j.jchromb.2018.08.007
- Kurosawa Y, Khandelwal P, Yoshikawa D, and Snyder M. Single-step influenza and dengue virus purification with mixed-mode CHT ceramic hydroxyapatite XT media. Bulletin 7115, Bio-Rad Laboratories, Inc. 2018.
https://www.bio-rad.com/webroot/web/pdf/psd/literature/Bulletin_7115.pdf
抗体
- Moro A, Yoshitake T, Ogawa T and Ichimura T. Single-step purification of pepsin-derived monoclonal antibody fragments from crude murine ascitic fluids by ceramic hydroxyapatite high-performance liquid chromatography. J Biochem. 144(6), 733-739, 2008. DOI: 10.1093/jb/mvn128.
- Saito M, Kurosawa Y and Okuyama T. Purification of anti-Japanese encephalitis virus monoclonal antibody by ceramic hydroxyapatite chromatography without Proteins A and G. Hybridoma (Larchmt). 31(1), 68-71, 2012. DOI: 10.1089/hyb.2011.0072.